三、填空说明题(本大题共5小题,30分)
16.(5分)从C、H、O、Na、S五种元素中选择适当元素,按下列要求用化学用语表示:
(1)以上元素中属于金属元素的是:___________
(2)碳酸根离子:___________
(3)O、Na、S组成的化合物中硫元素的化合价为+6价:___________
(4)一个中和反应的化学方程式:_____________________________
17.(5分)2015年3月22日《华商报》报道:中石化将投巨资防止水污染事件重演,一年前兰州市自来水苯超标污染事故终于有了完结篇。一年前水污染事故是由兰州威立雅水务集团两水厂之间自流沟内水体受周边地下含油污水污染所致。请回答下列问题:
(1)专家建议:将对含油污水煮沸10分钟左右,并将蒸发的气体通过通风设施排除室外,可去除水中绝大部分苯,由此可以推断苯具有的物理性质是________。
(2)在上述受污染的水中投放活性炭会除去苯,这是利用了活性炭的__________性,在该种水净化过程中发生___________(填“物理”或“化学”)变化。
(3)净化后的自来水属于硬水,长期使用硬水给生活和生产带来很多麻烦,生活中常用___________区分硬水和软水,常用___________方法降低水的硬度。
18.(6分)镁是一种重要的金属,广泛应用于空间技术、航空、汽车和仪表等工业部门。
(1)下图A是镁原子结构示意图,在图B—E所表示的四种粒子中,与镁原子化学性质相似的是___________;
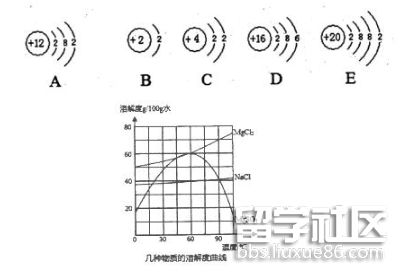
(2)制取金属镁的原料常用氯化镁。右图是氯化钠、氯化镁和硫酸
镁三种物质的溶解度曲线:
①30℃时,三种物质溶解度由大到小的顺序是__________ ;
②海水晒盐后剩余的液体——“苦卤”中主要含有氯化镁、氯化钠和硫酸镁等物质,若将60℃的“苦卤”继续加热蒸发,首先析出的晶体应是___________;
③工业上一般不用冷却结晶的方法从“苦卤”中分离获取氯化钠,其原因是_________________。
(3)工业上常利用电解熔融氯化镁的方法制取金属镁。电解时化合物中显正价的元素在阴极形成单质析出,则获得金属镁的电极是___________(填“阳极”或“阴极”)
19.(8分)2014年8月2日,江苏昆山市开发区中荣金属制品有限公司汽车轮毂抛光车间在生产过程中发生爆炸,造成75人死亡,185人受伤。请你用所学的化学知识回答下列问题:
(1)镁粉用于汽车轮毂抛光。干燥的镁粉在空气中遇到明火极易燃烧或爆炸,写出相关的化学方程式______________________;根据镁粉的性质,你认为下列镁粉的保存方法正确的是___________(填序号)
A.储存于干燥通风的仓库内
B.隔绝空气密封保存
C.敞口露天堆放
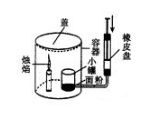
(2)亮亮同学利用右图装置模拟粉尘爆炸实验,操作如下:
在小塑料筒里放入干燥的面粉,点燃蜡烛,用塑料盖盖住金属筒,打气筒压人大量空气,不久,便会听到“砰”的一声,爆炸的气浪将金属筒上的塑料盖掀起。
①该实验中鼓人空气的作用___________________。
②近期我国全面开展排查粉尘生产,请你提出应采取的安全措施________________。(写一点)
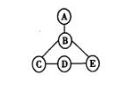
20.(6分)A~E均为初中化学中常见的物质,它们之间的关系如图
所示,相互之间连线表示能发生化学反应。已知A和B反应时火星四射,C、D、E为不同类别的化合物,E的溶液为蓝色。回答下列问题:
(1)A物质的化学式___________。
(2)C物质的类别为___________。
(3)D、E反应的化学方程式可能为______________________。
四、实验探究题(本大题共3小题,共25分)
21(7分)某同学在实验室里制取CO2和验证CO2的某些性质,根据如图回答问题。
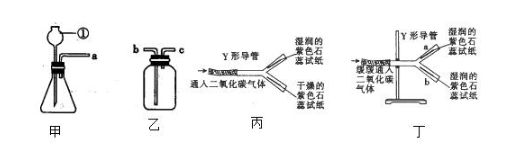
(1)写出图中仪器①的名称:______________。
(2)装置甲中应添加液体试剂的名称是___________________。
(3)用装置乙收集CO2时,导管口a应与_________(填“b”或“c”)相连。
(4)图丙中Y形导管平放于桌面,实验中可观察到的现象是_____________________,若把Y形导管固定在铁架台上(如图丁),a管位于上方,b管位于下方,两片石蕊试纸均湿润,可观察到b管中试纸变色比a管明显,原因是________________________________。
22.(8分)在学习盐的化学性质时,老师将一定量的碳酸钠溶液与氯化钙溶液混合,过滤反应后的混合物。老师要求同学们探究滤液中溶质的组成。请你一同参与探究并回答有关问题。
【查阅资料】碳酸钠溶液显碱性,氯化钠、氯化钙溶液显中性。
【提出猜想】
猜想1:滤液中溶质是NaCl;
猜想2:滤液中溶质是NaCl和___________的混合物(填化学式);
猜想3:滤液中溶质是NaCl和Na 2CO3的混合物。
猜想4:滤液中溶质是NaCl、Na 2CO3和CaCl2的混合物。
你认为上述猜想__________有错误,理由是_________________________________。
【实验探究】
(1)取少量滤液于试管中,滴加2-3滴无色酚酞试液,振荡,无明显现象。同学们认为猜想________不成立。
(2)另取少量滤液于另一支试管中,滴加碳酸钠溶液,若有_____________(填实验现象),证明猜想2成立。
【问题讨论】
小红同学认为要证明猜想2成立也可以改用硝酸银溶液。你认为小红同学__________(填“能”或“不能”)达到实验目的。理由是_________________________
23.(10分)小张同学利用硫酸铜进行趣味实验,将浸泡了蓝色硫酸铜溶液的滤纸在酒精灯火焰上点燃,观察到滤纸颜色变白,由湿变干后燃烧。在燃烧后的灰烬中出现红色固体。他很好奇,进行了相关探究,请你参与并回答有关问题:
【提出问题】红色固体是什么物质?它是如何产生的?
【查阅资料】
(1)温度达200℃时,CuS04开始分解生成Cu0和另一种氧化物;此反应前后各元素的化合价
保持不变。
(2)温度超过l00O℃,Cu0才分解生成红色的氧化亚铜(Cu2O);
【作出猜想】红色固体①可能是Cu;②也可能是Cu20;③还可能是Cu 和Cu20的混合物。
【实验探究】
(1)取红色固体观赏,呈亮红色:
(2)取少量红色固体于试管中,加入稀硫酸,固体不溶解,溶液仍为无色。
【分析推理】
(1)请教老师可知:如有Cu2O存在,加入稀硫酸会发生如下反应:Cu2O+H2S04=CuSO4+Cu+
H2O;结合实验探究的现象,确定亮红色固体为______,同时也说明滤纸燃烧时的温度低于____________。
(2)滤纸主要是由碳、氢、氧三种元素组成的,经分析,产生红色固体的原因可能是滤纸在燃烧过程中产生的碳与分解产生的Cu0发生反应,生成亮红色固体和二氧化碳,请写出该反应的化学方程式_________________________。
【交流讨论】
(1)将浸有硫酸铜溶液的滤纸点燃,刚开始不能燃烧,是因为_________________________。
(2)此实验中,CuS04受热分解生成Cu0和______(填化学式)。
五、计算题(本大题包括1小题,共10分)
24.(10分)有碳酸钙和氧化钙的混合物10 g,为了测定其中碳酸钙的质量分数,向其中加入一定量10%的稀盐酸,完全反应后产生气体的情况如右图所示。
(1)10 g混合物与盐酸反应后生成的二氧化碳最多是______ g。
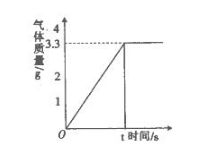
(2)混合物中碳酸钙的质量分数。(写出计算过程)
(3)10g混合物完全反应需要10%的盐酸的质量是______g(结果保留一位小数)。
| 语文试题 | 数学试题 | 英语试题 | 政治试题 | 物理试题 | 化学试题 | 历史试题 |
| 语文答案 | 数学答案 | 英语答案 | 物理答案 | 化学答案 | 历史答案 | 政治答案 |

